一�、 目的
為了保障受試者的安全,規(guī)范研究者和申辦者報告安全性信息的流程�。
二、 范圍
適用于本醫(yī)院開展的各期臨床試驗�����。
三��、 具體流程
(一) 藥物臨床試驗中安全性信息包括:
1. 臨床試驗實施中為消除對受試者緊急危害的試驗方案的偏離或者修改�。
2. 增加受試者風險或者顯著影響臨床試驗的試驗改變。
3. 所有可疑且非預(yù)期嚴重不良反應(yīng)(SUSAR)
4. 可能對受試者的安全或臨床試驗的實驗產(chǎn)生不利影響的新信息��。
5. 研究期間安全性更新報告。
6. 其他重大的安全性信息�����。
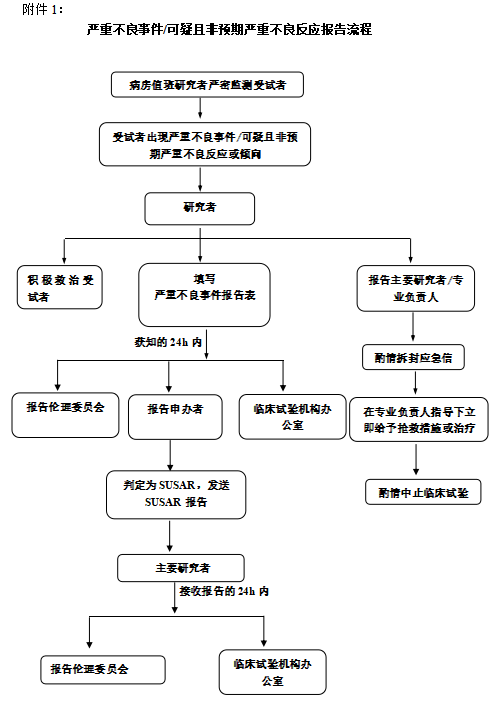
(二) 報告流程
1.一旦發(fā)生嚴重不良事件�����,除試驗方案或者其他文件(如研究者手冊)中規(guī)定不需立即報告的嚴重不良事件外�,研究者在獲知受試者出現(xiàn)SAE時�����,及時通知主要研究者�,按照相關(guān)SOP處理,并在24小時內(nèi)報告至申辦方�、臨床試驗機構(gòu)辦公室及臨床試驗倫理委員會。研究者還應(yīng)當及時提供詳盡�、書面的隨訪報告。 涉及死亡事件的報告�����,研究者應(yīng)當向申辦者��、臨床試驗機構(gòu)和倫理委員會提供其他所需要的資料,如尸檢報告和最終醫(yī)學報告�����。
2.申辦方應(yīng)在接收到SAE報告之后盡快評估是否為SUSAR��。
3.本中心SUSAR:對于本中心致死或危及生命的SUSAR�,申辦方應(yīng)在首次獲知7天內(nèi)(申辦方首次獲悉當天為第0天)將SUSAR報告處理意見報告主要研究者,主要研究者報告?zhèn)惱砦瘑T會和臨床試驗機構(gòu)辦公室�����,并在隨后的8天內(nèi)報告和完善隨訪信息�;對于非致死性或危及生命的SUSAR,申辦方應(yīng)在首次獲知后15天內(nèi)將SUSAR報告處理意見報告主要研究者�,主要研究者盡快上報倫理委員會和臨床試驗機構(gòu)辦公室,后續(xù)30天內(nèi)跟蹤隨訪盡早報告給各部門��。
4.非本中心的SUSAR:需定期匯總并報告(匯總列表+每例報告表)�,每三個月遞交1次。
5.任何顯著影響研究進行或增加受試者風險的SUSAR:申辦者獲知7天內(nèi)將SUSAR報告處理意見報告主要研究者�����,主要研究者上報倫理委員會和臨床試驗機構(gòu)辦公室��。
6.SAE/SUSAR遞交要求:
遞交倫理委員會(先將郵件發(fā)送至倫理委員會郵箱hyszxyy_irb@163.com;隨后馬上準備和郵箱內(nèi)容相同的紙質(zhì)資料遞交倫理�����,由倫理秘書處進行SAE審查��、備案及安排SUSAR審查)
l 紙質(zhì)《SAE/SUSAR報告表》(原件�,1份);
《PI TO 倫理遞交信》(原件�,一式2份);
其他相關(guān)材料
l 郵件報告聯(lián)系方式
單位 | 聯(lián)系人 | 聯(lián)系方式 |
臨床試驗倫理委員會 | 李德斌 | 電話:15211817561
郵箱:hyszxyy_irb@163.com |